Πέρασαν 2 χρόνια ακριβώς από την παρουσίαση της μελέτης που πραγματοποίησε μεγάλη συμβουλευτική εταιρεία για λογαριασμό της Γενικής Γραμματείας Βιομηχανίας.
Όπως κάθε μελέτη που συντάσσεται από μια μεγάλη εταιρεία είχε την αξιολόγηση της υφιστάμενης κατάστασης της ελληνικής φαρμακοβιομηχανίας ,τις διεθνείς τάσεις και πρακτικές ,ανάλυση SWOT και κατέληγε στην εθνική στρατηγική για την παραγωγή φαρμακευτικών προϊόντων μαζί με τις αντίστοιχες προτάσεις για την υλοποίηση της.
Είχε αναλυθεί και είχε επισημανθεί, από εδώ, ότι στην προσεκτική ανάγνωση της θα έπρεπε να λείψει παντελώς ο συναισθηματισμός αλλά και η υπέρμετρη φιλοδοξία και ότι επιβαλλόταν να δει κανείς τα θετικά στοιχεία της μελέτης αλλά κυρίως να σταθεί περισσότερο στα αρνητικά. Αυτά που εμποδίζουν την ανάπτυξη, κάνουν μη ανταγωνιστική την παραγωγή φαρμάκου στην Ελλάδα και απαγορεύουν τις εξαγωγές!
Σήμερα, οι ελληνικές φαρμακευτικές επιχειρήσεις εξάγουν σε 139 χώρες και όχι σε 85 όπως πολλοί ισχυρίζονται. Πρέπει όμως να δει κανείς πόσες και ποιες εταιρείες εξάγουν και αν αυτές ακολουθούν το νόμο Pareto (80/20).Το 99% των εξαγωγών καλύπτουν χώρες που άμεσα ή το αργότερο μέχρι το 2019 θα έχουν υιοθετήσει τον νέο κανονισμό για τα ψευδεπίγραφα.
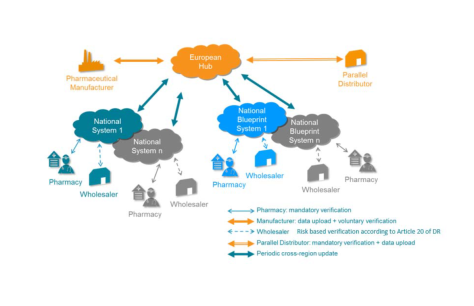
Εάν δεν εφαρμοστεί έγκαιρα ο κανονισμός για τα ψευδεπίγραφα φάρμακα δεν θα μπορούν να γίνουν εξαγωγές σε χώρες της Ε.Ε, των ΗΠΑ, του Καναδά και της Αυστραλίας που θα εφαρμόζουν τον κανονισμό ή απαιτούν ήδη πολύ αυστηρούς κανόνες επικύρωσης και επαλήθευσης.
Σε όλη την Ε.Ε μετράνε τις ημέρες (145) με ακρίβεια δευτερολέπτου(!) για την εφαρμογή του. Όλες οι χώρες , πλην Ιταλίας είναι πλέον έτοιμες και έχουν συστήσει το εθνικό τους NMVO ανακοινώνοντας τα κόστη λειτουργίας και τα κόστη εγγραφής των κατόχων άδειας κυκλοφορίας (ΚΑΚ).
Στην Ελλάδα το καλοκαίρι του 2017, λόγω και της παράτασης που είχε δοθεί, έγινε μια μελέτη από κάποιους εκ των ενδιαφερομένων μερών για τη σύσταση και λειτουργία του ελληνικού NMVO.
Σε αυτήν, κάποιοι και χωρίς πραγματικά δεδομένα, είχαν κάνει μια υπερβολική και αυθαίρετη εκτίμηση για τα κόστη αποθαρρύνοντας τους εταίρους του ελληνικού NMVO να προχωρήσουν στην ίδρυση του. Δυστυχώς άφησαν κακή παρακαταθήκη που τώρα πρέπει να πληρωθεί πολύ ακριβά δημιουργώντας προβλήματα στις εξαγωγές από το Φεβρουάριο του 2019.
Αλλά ακόμα και σήμερα εάν αποφασιζόταν να δημιουργηθεί ο ελληνικός NMVO, θα περνούσε μεγάλο χρονικό διάστημα για να αποφασιστεί ποιος από τους πέντε end-to-end εταίρους θα καταβάλει το κόστος και σε ποιο ποσοστό για τα διαφορετικά στάδια της εφοδιαστικής αλυσίδας.
Μέχρι λοιπόν να συσταθεί ο ελληνικός NMVO, οι ΚΑΚ πρέπει να συνάπτουν σύμβαση σε εθνικό επίπεδο κάθε χώρας που κάνουν εξαγωγή. Αν το κόστος κάποτε ήταν υψηλό σήμερα θεωρείται δυσθεώρητο γιατί το ισχύον μοντέλο αμοιβής εξαρτάται από τον κάθε NMVO, ο οποίος έχει ένα ξεχωριστό μοντέλο αμοιβής. Όμως και το κόστος εγγραφής και τα ετήσια τέλη λειτουργίας σε κάθε μια χώρα ποικίλουν σημαντικά.
Στην προαναφερθείσα μελέτη , ο 2ος πυλώνας που αναφερόταν στην ανάπτυξη των εξαγωγικών δραστηριοτήτων, είχε σαν στόχο την εκπόνηση στοχευμένων μελετών για τη διείσδυση σε νέες αγορές βάσει των ειδικών αναγκών κάθε αγοράς και δράσεις υποστήριξης της εξωστρέφειας των ελληνικών επιχειρήσεων.
Τι νόημα λοιπόν έχει να κάνει η πολιτεία και οι εταιρείες, μελέτες, υπηρεσίες μάρκετινγκ, έρευνες αγοράς ,τρόπους διείσδυσης στις αγορές εξωτερικού και πολλά άλλα, με τεράστιο κόστος, προκειμένου να βρεθούν αγοραστές στο εξωτερικό, όταν δεν θα μπορεί το προϊόν τους να εξαχθεί γιατί πλέον θα πρέπει να καταβάλει επιπλέον πόρους όσο και προσπάθεια για να παραμείνουν στις ήδη υπάρχουσες αγορές.
Εάν δεν υπήρχε το επιχειρηματικό πνεύμα, η επιχειρηματική έμπνευση, το επιχειρηματικό ρίσκο και η επιχειρηματική καινοτομία στην εγχώρια φαρμακοβιομηχανία τα πράγματα θα ήταν πάρα πολύ δύσκολα. Ακόμα και η σπάνια περίπτωση 2-3 εξαιρετικών ελληνικών επιχειρήσεων που αυξάνουν τις εξαγωγές τους κάθε χρόνο θα βρεθούν σε πολύ δύσκολη θέση για να τις διατηρήσουν!
Υπάρχει λίγος χρόνος ακόμα εάν πραγματικά κάποιοι επιθυμούν να υπάρχουν εξαγωγές φαρμάκων σε άλλες χώρες αρκεί να υπάρχει σωστή πληροφόρηση, με αληθινά στοιχεία όσον αφορά τα κόστη, τον επιμερισμό τους και κυρίως την αναγκαιότητά της σύστασης και λειτουργίας του ελληνικού NMVO.
Εάν δεν αξιοποιηθεί αυτός ο ελάχιστος χρόνος οι εξαγωγές φαρμάκων το 2019 θα μειωθούν τουλάχιστον κατά 20%, χωρίς σε αυτές να συμπεριλαμβάνονται και οι παράλληλες εξαγωγές. Μαζί με αυτές, προβλέπεται η μείωση θα ξεπεράσει το 40%!
ΜΕΛΕΤΕΣ: ΑΠΟ ΤΗΝ ΘΕΩΡΙΑ ΣΤΗΝ ΠΡΑΞΗ
Εξαγωγές φαρμάκων: Προσεγγίζοντας την αλήθεια II
ΕΥΔΙΑΚΡΙΤΑ ΠΛΕΟΝ ΤΑ ΚΟΣΤΗ ΣΤΟΥΣ NMVO
Προβληματισμοί γύρω από τον κανονισμό για τα ψευδεπίγραφα φάρμακα και την λειτουργία του NMVO.
Η ανάγκη ίδρυσης ενός Εθνικού Οργανισμού Επαλήθευσης Φαρμάκων (NMVO). στην Ελλάδα
Serialisation: Σχέσεις CMOs και επωνύμων εταιρειών. Τι πρέπει να γίνει.
Η ελληνική φαρμακοβιομηχανία σε κρίσιμο σταυροδρόμι. Προκλήσεις και εμπόδια.
ΨΕΥΔΕΠΙΓΡΑΦΑ ΦΑΡΜΑΚΑ ΚΑΙ ΕΛΛΗΝΙΚΗ ΠΡΑΓΜΑΤΙΚΟΤΗΤΑ
ΝΕΕΣ ΠΡΟΚΛΗΣΕΙΣ ΤΗΣ ΕΛΛΗΝΙΚΗΣ ΦΑΡΜΑΚΟΒΙΟΜΗΧΑΝΙΑΣ ΣΤΟΝ ΕΥΡΩΠΑΪΚΟ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟ ΤΗΣ
ΕΙΝΑΙ ΕΤΟΙΜΗ Η ΦΑΡΜΑΚΟΒΙΟΜΗΧΑΝΙΑ ΓΙΑ ΤΗΝ ΕΦΑΡΜΟΓΗ ΤΟΥ ΝΕΟΥ ΚΑΝΟΝΙΣΜΟΥ ΓΙΑ ΤΑ ΨΕΥΔΕΠΙΓΡΑΦΑ?